Salut ! 
Alors rappelons quelques petites bases :
- Pour caractériser la
force d’un acide, on regarde la
stabilité de sa base conjuguée (ça du coup c'est bon pour toi)- Pour caractériser la
force d’une base, on regarde son
enrichissement en électrons (c'est parti pour une petite explication)La méthode de détermination de la force d'une base est complètement différente de celle de la détermination de la force d'un acide.
Pour déterminer la force d'une base, pas besoin de de regarder la stabilité de son acide conjugué, il suffit de regarder l'enrichissement en électrons de l'espèce même. En effet plus celui-ci est important (mésoméries donneuses / effets inductifs donneurs), plus la base est forte. C'est logique : plus une base est enrichie en électrons (charges négatives), plus le recrutement d’un proton (charge positive) par la base est favorisé.
Illustrons tout cela avec un exemple :
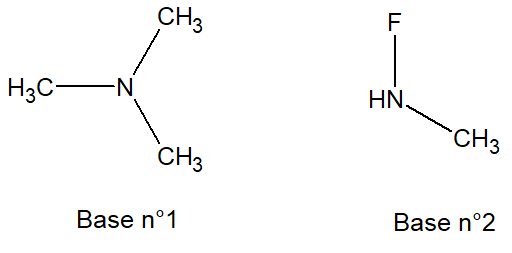
- nl visiblement.png (4.17 Kio) Vu 958 fois
Laquelle de ces 2 bases est la plus forte ?
Base n°1 :
- 2 groupements alkyles → 2 effets inducteurs donneurs → chargent fortement la base en électrons
On a donc une base
FORTE.
Base n°2 :
- 1 groupement alkyle → 1 effet inducteur donneur → charge faiblement la base en électrons
- 1 atome électronégatif → 1 effet inducteur attracteur → décharge la base de ses électrons
On a donc une base
FAIBLE.
La
base n°1 est donc plus forte que la base n°2, car elle
plus riche en électrons... tout simplement !
C'est bon pour toi ?
Bon courage ! 





