Coucou !

Avant toute chose, sache que ce n'est pas une partie sur lequel le prof va insister, surtout le jour de l'examen, c'est très théorique et il préfere quand même la pratique mais... sait on jamais !

J'ai l'impression que tu as confondu ce qu'on va ammener à faire avec notre hybridation sp2 et ce qu'est une hybridation sp2.
Alors, déjà voyons commence va être fais notre hybridation sp2 :
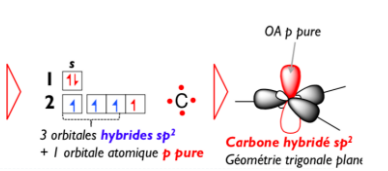
- Reponse 1.PNG (26.3 Kio) Vu 376 fois
Sur le schéma on voit comme tu l'a dit que notre hybridation est composé de 3 orbitales hybrides sp2 (en gris sur le schéma à droite) et 1 orbitales p pures (en rouge).
Maintenant, l'hybridation sp2 va se traduire dans l'espace en une double liaison, donc il va falloir qu'on assemble non pas 1, mais 2 atomes de carbones ! (Je pense que c'est la ou t'as du t'embrouiller).
Donc pour assembler nos deux atomes de carbones et former cette double liaison ils vont chacun mettre en commun 1 liaison simple qui est entourée d'orbitale sp2 (donc 2 comme tu vois sur le schéma en gris qui s'assemble ) et un système pi qui lui est entouré de 2 Orbitale p pur (les deux en rouge sur le schéma).
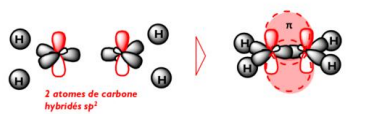
- Réponse 2.PNG (44.4 Kio) Vu 376 fois
Comme je l'ai dit c'est une notion hyper théorique donc je vois mal le prof piéger dessus.
J'espère avoir répondu à ta question sinon n'hésite pas !
Bon courage !
(Incroyable la photo de profil)





 Tuteur de Chimie 2021/2022
Tuteur de Chimie 2021/2022 
